Sophie Polo Dans les coulisses du chromosome X : comment réparer l’ADN cassé
Directrice de recherche à l’Inserm, cheffe de l’équipe « Intégrité de l’épigénome » au Centre Epigénétique et Destin Cellulaire de l’Université Paris Cité, Paris
- 2025 • Impulscience

Les chromosomes, gardiens de notre identité génétique, subissent des dommages qui peuvent compromettre la santé et le destin des cellules. Parmi eux, les cassures double brin de l’ADN figurent parmi les plus critiques. Sophie Polo s’intéresse à la manière dont les cellules réparent ces cassures, en étudiant un phénomène unique chez les mammifères femelles : l’inactivation du chromosome X.
L’ADN, une structure à la fois souple et vulnérable
Dans le noyau des cellules, le matériel génétique est organisé sous forme de chromatine : un assemblage d’ADN et de protéines appelées histones. Cette structure assure à la fois la stabilité de l’ADN et sa flexibilité, permettant d’activer ou désactiver certains gènes selon les besoins de la cellule.
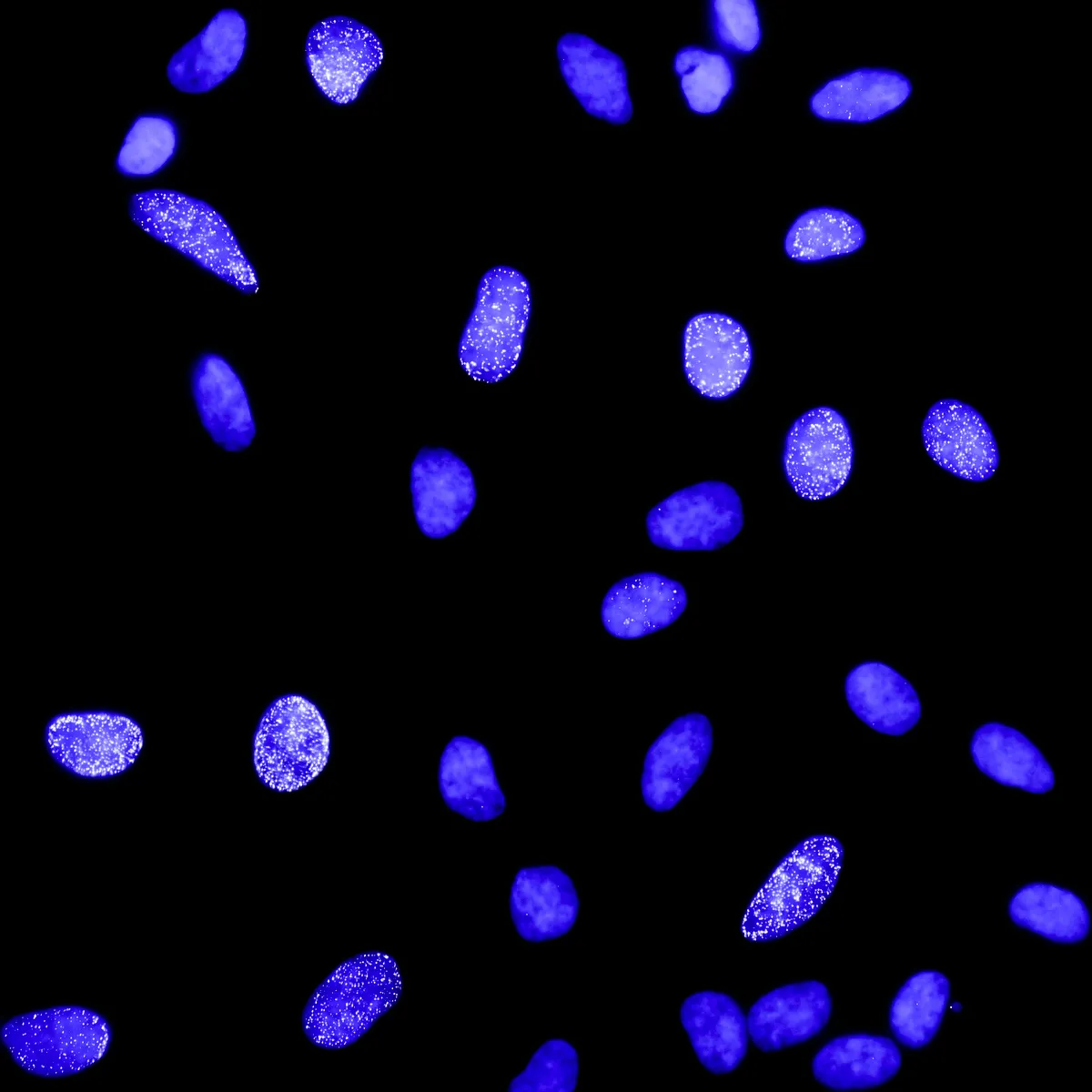
Malgré cette organisation sophistiquée, l’ADN reste fragile. Il peut subir et entretenir des cassures, notamment celles appelées « cassures double brin » qui touchent les deux brins de l’ADN, ce qui déclenche des mécanismes de réparation. La manière dont la chromatine est structurée joue alors un rôle crucial dans cette réparation.
L’hétérochromatine facultative : une chromatine pas comme les autres
La chromatine peut adopter plusieurs formes : l’euchromatine, de structure globalement décondensée permettant l’expression des gènes, et l’hétérochromatine, la forme la plus dense et compacte. L’hétérochromatine est dite « silencieuse » ou inactive car elle empêche l’expression des gènes. Ce type de chromatine peut être employé dans la cellule de façon transitoire pour réguler l’expression des gènes de manière « facultative », étant ainsi particulièrement importante dans le développement embryonnaire et pour protéger les cellules contre des maladies, comme le cancer ou des maladies auto-immunes.
Un cas particulier de ce type d’hétérochromatine facultative est l’inactivation du chromosome X chez les cellules de femelles mammifères. Elles possèdent deux chromosomes X et l’un des deux est rendu inactif au début du développement embryonnaire afin d’éviter une double dose des gènes présents sur ce chromosome. Ce chromosome X inactif reste silencieux tout au long de la vie. Malgré la fréquence élevée des cassures d’ADN dans le chromosome X inactif, on en sait très peu sur la manière dont celui-ci réagit aux cassures de l’ADN et influence leur réparation.
Le chromosome X et les secrets de son inactivation
Le projet Impulscience porté par Sophie Polo vise à lever le voile sur les mécanismes de réparation de l’ADN dans le chromosome X inactif. En utilisant des stratégies innovantes combinant l’édition du génome, l’imagerie et la protéomique, son équipe cherche à comprendre si et comment l’hétérochromatine régule la réparation des cassures double brin d’ADN. Ils identifieront ainsi les changements dans la chromatine qui accompagnent la réparation des cassures et caractériseront les mécanismes qui assurent le maintien de l’inactivation du chromosome X en réponse aux cassures. Enfin, ils examineront le rôle des cassures dans le déclenchement de l’inactivation du chromosome X au cours du développement embryonnaire.
Ce projet apportera des connaissances sans précédent sur les mécanismes de mise en place et de maintien de l’inactivation du chromosome X en réponse à des dommages dans l’ADN. Ceci a des implications importantes pour la compréhension des différences entre les sexes en matière de susceptibilité aux maladies.
Sophie Polo en quelques mots
Après ses études à l’Ecole Normale Supérieure de Paris, elle a effectué son doctorat à l’Institut Curie, où elle a étudié les liens entre l’assemblage de la chromatine, la division cellulaire et la stabilité du génome. Elle a réalisé un séjour post-doctoral à l’Institut Gurdon à Cambridge (Royaume-Uni) dans le laboratoire de Sir Steve Jackson, suite auquel elle rejoint l’Inserm en 2011. Elle fonde en 2013 l’équipe « Intégrité de l’épigénome » à l’Université Paris Cité, avec pour ambition de décrypter les interactions entre le génome et les modifications de la chromatine, en conditions normales comme pathologiques.

Programme Impulscience
Impulscience attribue chaque année 7 nouveaux soutiens à des chercheuses et chercheurs en sciences de la vie. Concentré sur le milieu de carrière, ce programme a pour objectif de soutenir cette étape cruciale pour le développement des projets de recherche.
Tous les lauréats du prix