Sagar Bhogaraju L’importance des étiquettes moléculaires pour l’activité des protéines
Chef de l’équipe « Biologie structurale de la signalisation de l'ubiquitine », Laboratoire Européen de Biologie Moléculaire (EMBL), Grenoble
- 2025 • Impulscience

Les protéines sont au cœur de toutes les activités de nos cellules. Pour remplir leurs multiples fonctions, elles peuvent être modifiées chimiquement, notamment par l’ajout d’« étiquettes » moléculaires comme l’ubiquitine. À l'aide d'une méthodologie innovante, Sagar Bhogaraju cherche à décoder l'univers des protéines ubiquitinées, en étudiant comment et pourquoi l'ubiquitine leur est ajoutée, aussi bien dans des contextes normaux que pathologiques, comme le cancer.
Les « étiquettes » moléculaires des protéines
La diversité des protéines leur permet de participer à tous les événements clés de la vie cellulaire, comme le métabolisme, le maintien de la structure ou encore la communication à l’intérieur de la cellule et avec l’extérieur. Pour ce faire, leur structure peut s’adapter, notamment grâce à l’ajout de modifications chimiques qui surviennent après leur fabrication.
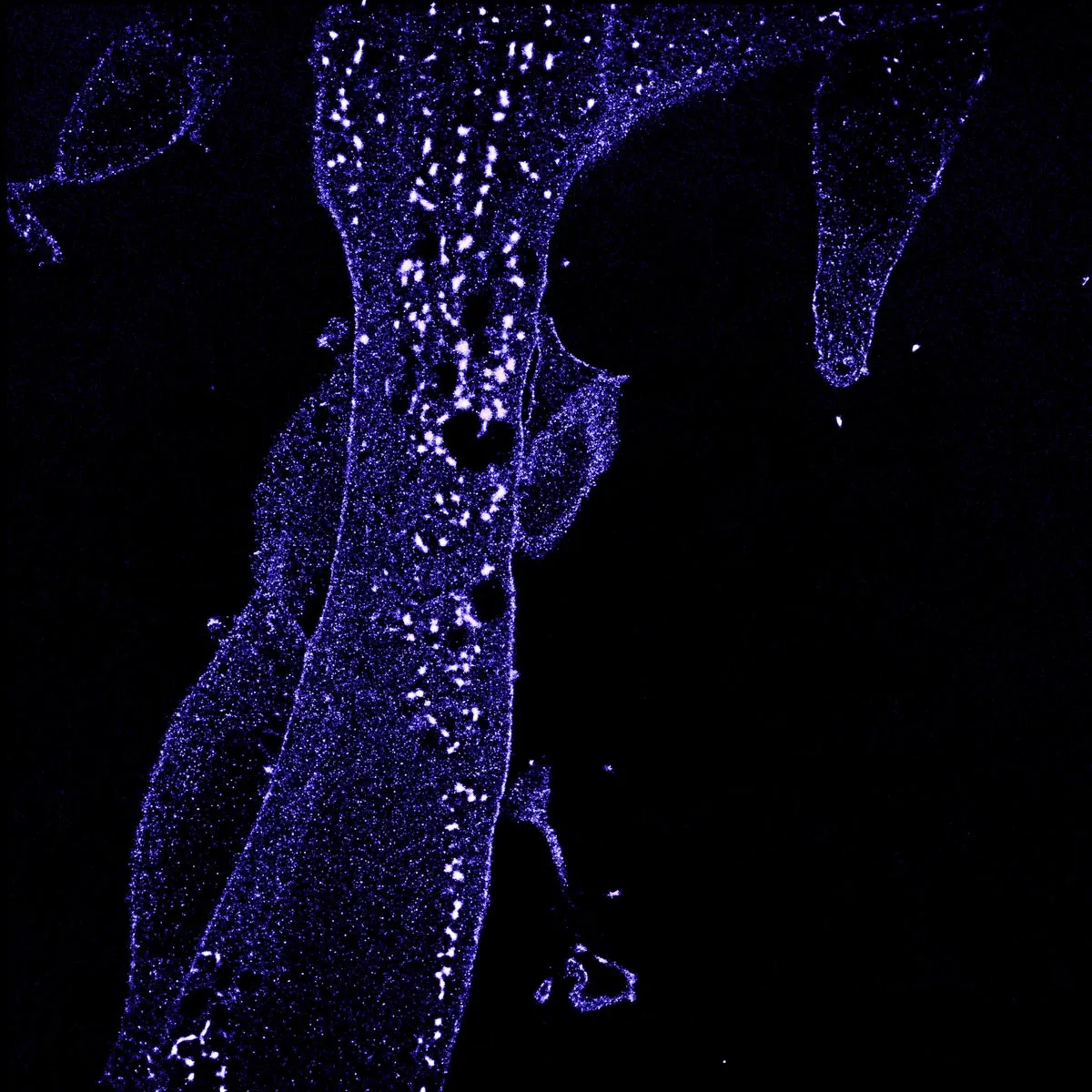
Parmi ces modifications, l’ajout d’« étiquettes » moléculaires, comme l’ubiquitine, joue un rôle clé. L’ubiquitine est une petite protéine qui peut être fixée sur d’autres protéines par des protéines appelées ligases. Cet ajout peut alors diriger le destin et la fonction de la protéine : elle peut servir comme signal pour la communication cellulaire, ou indiquer à la cellule de détruire la protéine modifiée.
En bonne santé ou lors d’un cancer : l’importance de l’ubiquitine
L’ubiquitine et les ligases qui l’attachent aux protéines sont essentielles au bon fonctionnement des cellules. Sagar Bhogaraju s’intéresse à un type d’ubiquitine ligases en particulier, les RING, dont la dérégulation est impliquée dans le développement de certains cancers. En effet, des facteurs appelés MAGE, présents en grandes quantités dans les cellules cancéreuses, interagissent avec les ligases RING et modifient leur activité, ce qui modifie l’ubiquitination et la dégradation de protéines clés pour le développement de cancers.
Malgré leur importance pour la signalisation cellulaire et le potentiel thérapeutique du système d’ubiquitination, très peu des protéines cibles des ligases RING sont connues à ce jour. En effet, la difficulté réside dans le fait que l’activité des ubiquitine ligases pour attacher l’ubiquitine à une protéine cible est extrêmement rapide et réversible, ce qui complique la tâche des chercheurs qui tentent de capturer leurs cibles.
L’atlas de l’ubiquitination pour développer de nouvelles thérapies
Grâce à Impulscience, Sagar Bhogaraju et son équipe pourront explorer l’univers des ligases RING, depuis leur régulation par les MAGE jusqu’à la découverte de leurs cibles. Pour surmonter les obstacles techniques, ils ont développé récemment une nouvelle méthode expérimentale appelée Ub-POD qui permet de « marquer » les protéines au moment précis où elles sont ubiquitinées, directement dans les cellules.
La première étape de ce projet sera consacrée à identifier des protéines cibles de 21 ligases RING impliquées dans des maladies comme le cancer ou certains troubles du développement du cerveau. L’équipe s’intéressera également à la régulation de l’activité des ligases RING dans le contexte du cancer, et utilisera la méthode Ub-POD pour identifier les protéines ubiquitinées dans le cerveau, dans le contexte de l’addiction à la cocaïne. Ce projet permettra de mieux comprendre les mécanismes liés à l’ubiquitination et d’ouvrir la voie à de nouvelles approches thérapeutiques ciblant ce système fondamental.
Sagar Bhogaraju en quelques mots
Sagar Bhogaraju est biochimiste, spécialisé dans l’étude de la structure et la régulation de l’activité des protéines. Après un master à l’Institut Technologique de l’Inde (Kanpur), il rejoint l’Institut Max Planck de biochimie à Munich (Allemagne), où il effectue un doctorat en biologie structurale, consacré à l’étude du cytosquelette, le réseau moléculaire qui assure l’intégrité et la forme des cellules. Il poursuit ensuite ses recherches postdoctorales à l’Université Goethe à Frankfurt (Allemagne) où il s’intéresse aux mécanismes d’ubiquitination chez les bactéries. Il rejoint l’EMBL à Grenoble en 2018 en tant que chef d’équipe. Depuis, il poursuit ses travaux sur l’ubiquitination, en les élargissant à des organismes plus complexes et en explorant de nouvelles approches expérimentales.

Programme Impulscience
Impulscience attribue chaque année 7 nouveaux soutiens à des chercheuses et chercheurs en sciences de la vie. Concentré sur le milieu de carrière, ce programme a pour objectif de soutenir cette étape cruciale pour le développement des projets de recherche.
Tous les lauréats du prix