Raphaël Rodriguez Exploiter la chimie de la cellule pour traiter le cancer et l’inflammation
Raphaël Rodriguez, Directeur de recherche CNRS, Chef de l’équipe «Chemical Biology» à l’Institut Curie, Paris
- 2023 • Prix Liliane Bettencourt pour les sciences du vivant

C’est en tissant des liens entre la chimie et la biologie que Raphaël Rodriguez a tressé son parcours scientifique. De Marseille à l’Institut Curie à Paris, en passant par Oxford et Cambridge au Royaume-Uni, Raphaël Rodriguez a développé une recherche innovante qui non seulement génère des pistes prometteuses pour de nouveaux traitements du cancer et de l’inflammation, mais qui offre aussi un regard original sur l’importance de la chimie pour le fonctionnement de la cellule.
Allier chimie et biologie, un processus naturel
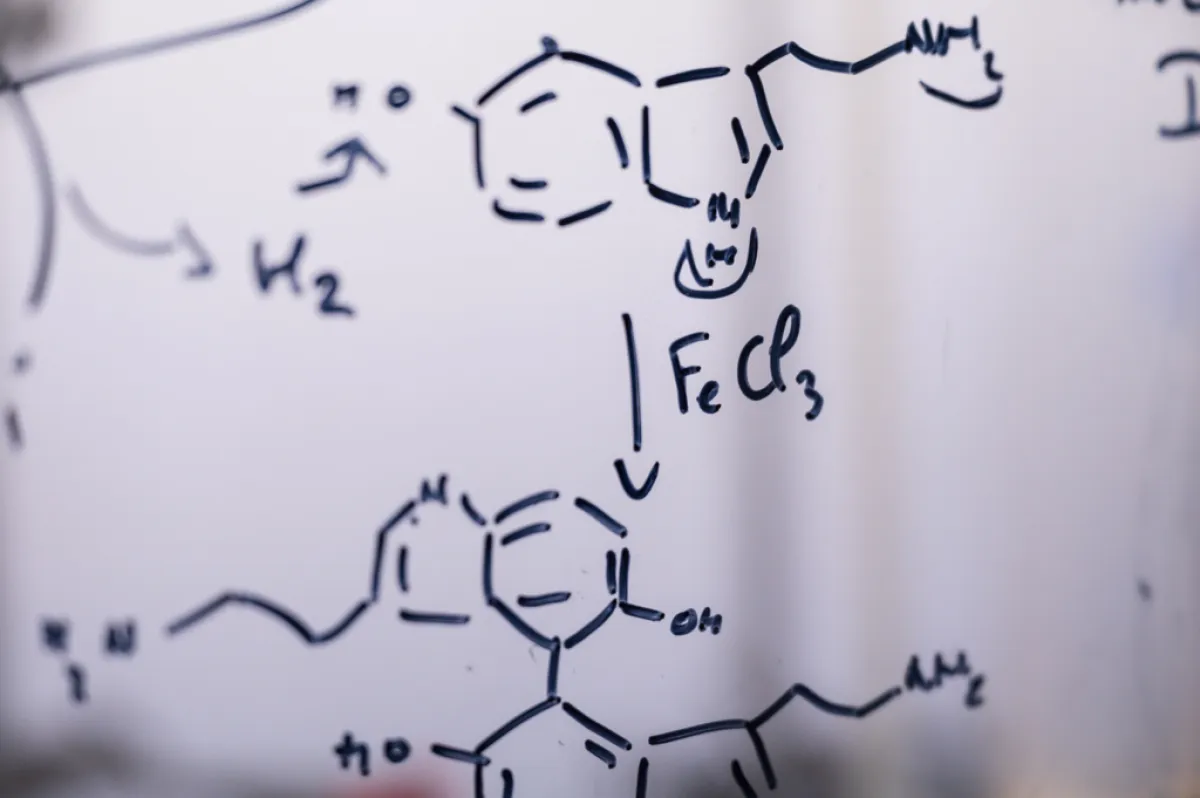
À travers sa recherche, Raphaël Rodriguez s’efforce d’avoir un impact sur la santé humaine. Chimiste de formation, son travail se concentre sur la conception de petites molécules pour disséquer les processus cellulaires liés au cancer, à l'inflammation et au vieillissement. Les effets induits par ces petites molécules lui permettent d'identifier de nouvelles cibles thérapeutiques. Au long de sa carrière, il a conçu des protocoles pour isoler et caractériser les cibles de petites molécules, et il a également développé des méthodes pour les visualiser dans les cellules afin de fournir des informations sur leur mécanisme.
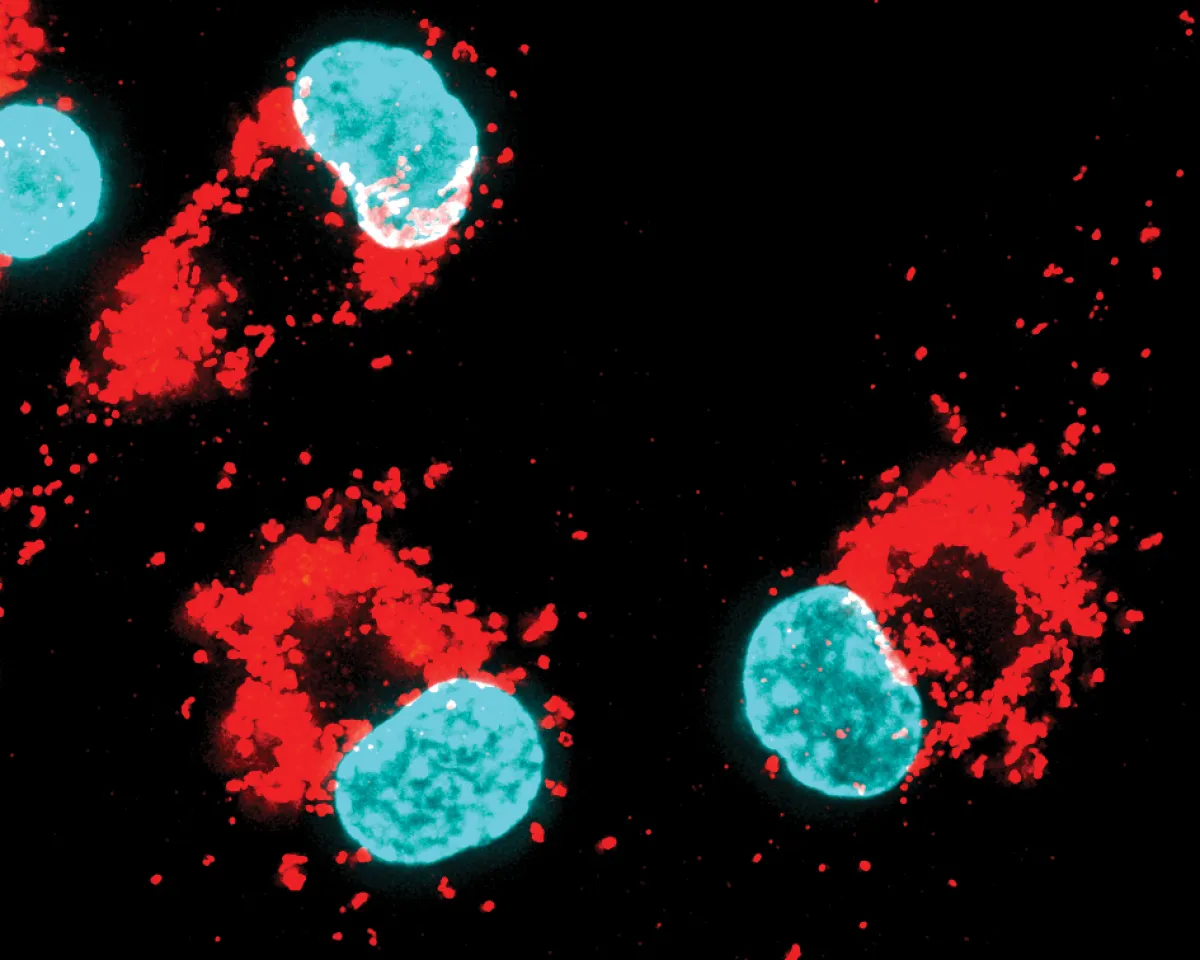
Pour citer quelques exemples, en établissant la synthèse de la marmycine A, Raphaël Rodriguez et son équipe ont découvert le mécanisme par lequel cette molécule induit la mort des cellules cancéreuses : en ciblant les lysosomes (organites cellulaires de recyclage/dégradation des molécules) et non l'ADN comme on le pensait auparavant. Ils ont également élucidé le mécanisme d'action de la salinomycine, un produit naturel capable d'éradiquer les cellules souches cancéreuses, dont on sait qu'elles contribuent aux métastases et aux rechutes. En synthétisant un dérivé de cette molécule, l'ironomycine, ils ont montré que ces composés séquestrent le fer dans le lysosome, favorisant ainsi l’oxydation des lipides dans les membranes conduisant à la mort cellulaire. Ces travaux ont révélé que les cellules cancéreuses présentent une forte charge en fer qui les rend vulnérables à une forme de mort cellulaire particulière, appelée la ferroptose. Cette observation les a amenés à découvrir un mécanisme d'absorption des métaux qui régule la plasticité des cellules cancéreuses et immunitaires.
En quête de l’impact sur la santé
Ces dernières découvertes ont permis à Raphaël Rodriguez d'identifier des voies de signalisation impliquant le cuivre et le fer qui semblent être des pistes prometteuses pour de nouveaux traitements contre le cancer et l’inflammation.
Avec son équipe, ils ont constaté que certaines cellules cancéreuses et immunitaires régulent à la hausse la protéine CD44, qui sert de médiateur à l'absorption du fer et du cuivre dans la cellule. Ce serait le cuivre à l’intérieur la cellule, plus précisément celui qui se trouve dans les mitochondries (organites cellulaires qui produisent de l’énergie, entre autres fonctions), qui stimulerait la production de métabolites importants pour l'activité de protéines dans le noyau de la cellule qui agissent en favorisant l'expression des gènes en lien avec la métastase et avec l'état d’inflammation. De manière intéressante, l'inactivation spécifique de ce cuivre par une petite molécule brevetée développée par Raphaël Rodriguez, la supformine, atténue l'inflammation aiguë in vivo.
Ainsi, les travaux de Raphaël Rodriguez et de son équipe ont révélé le rôle central des métaux en tant que régulateurs de transitions entre état cellulaire dans le cancer et l'inflammation. Les mécanismes, les cibles médicamenteuses et les vulnérabilités dans cette voie de signalisation pourront être exploitées pour une intervention thérapeutique, rapprochant le chercheur de son ambition à long terme : impacter la santé.
« Ma carrière a été dominée par l'idée que mes actions auraient un impact sur la santé. »
Raphaël RodriguezLauréat 2023 du Prix Liliane Bettencourt pour les sciences du vivant
 Écouter le podcast
Écouter le podcast
Raphaël Rodriguez par Thomas Bronnec
Raphaël Rodriguez en quelques mots
Originaire d’Avignon, Raphaël a obtenu son doctorat à Marseille et Oxford et poursuivi sa formation post-doctorale à Cambridge (Royaume-Uni). Chercheur à l’Institut de Chimie des Substances Naturelles (Gif-sur-Yvette) au CNRS entre 2012 et 2015, il dirige une équipe de recherche à l’Institut Curie depuis 2015. Depuis, il a obtenu un financement ERC Consolidator et de nombreuses distinctions, comme le Tetrahedron Young Investigator Award en 2019. Il est membre de la Royal Society of Chemistry et Chevalier de l'Ordre National du Mérite.

Prix Liliane Bettencourt pour les sciences du vivant
Le Prix Liliane Bettencourt pour les sciences du vivant récompense chaque année un chercheur de moins de 45 ans pour l’excellence de ses travaux et sa contribution remarquable à son domaine de recherche scientifique. Ce prix est attribué selon les années à un chercheur établi en France ou travaillant dans un autre pays d'Europe. Vingt-sept lauréats ont été récompensés depuis 1997. A partir de 2023, la dotation de ce prix récompense personnellement le lauréat à hauteur de 100 000 euros.
Tous les lauréats du prix