Malene Jensen Et si le désordre était important pour organiser la signalisation dans la cellule ?
Malene Jensen, directrice de recherche CNRS, Institut de Biologie Structurale, Grenoble, France
- 2022 • Impulscience


Les cellules sont sollicitées en permanence par des signaux internes et externes, qui requièrent une réponse en temps et en heure. La spectroscopie par résonance magnétique nucléaire est une technique qui va livrer à Malene Jensen et à son équipe les détails de l’organisation de cette tâche dans les cellules, avec une spécificité et une pertinence extrême.
Des échafaudages pour organiser les signaux dans la cellule
La cellule possède des systèmes efficaces qui lui permettent de traduire des signaux internes et externes en actions. Ces signaux sont transmis dans la cellule par des groupes de molécules qui s’associent et qu’on peut imaginer comme une sorte de relais, pour aboutir aux conséquences de ce signal. C’est comme cela que, par exemple, une cellule du muscle peut remarquer la présence d’insuline dans le sang et mettre en place une réponse adaptée qui va lui permettre d’importer du glucose. Si l’on imagine la grande quantité de protéines qui se trouvent dans une cellule, il est remarquable qu’elles puissent s’organiser pour traiter correctement, et avec une très grande fidélité, le vaste éventail d'informations qu'elles reçoivent en permanence. Pour cela, les protéines adéquates doivent s’associer à la bonne place et au bon moment pour transmettre les bons messages. Cette prouesse est en partie accomplie grâce aux protéines dites d’échafaudage, qui servent de plateformes pour regrouper physiquement les différents composants d’une voie de signalisation.
La vie désordonnée des protéines d’échafaudage
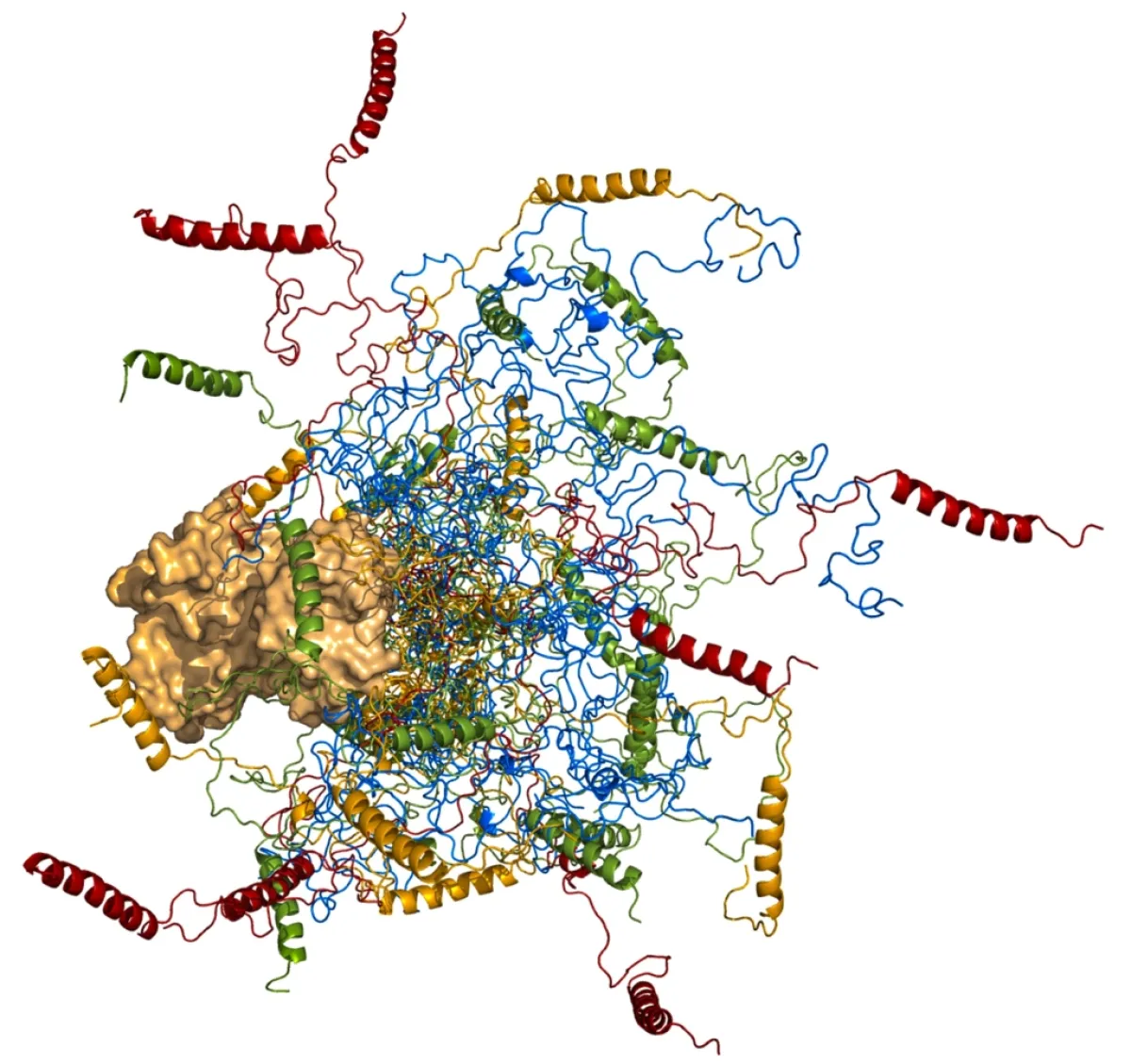
Les protéines d’échafaudage sont un groupe de protéines très diverses. Cependant, elles partagent le fait d’avoir des zones de « désordre » dans leur structure moléculaire. Ceci constitue un vrai défi car elles sont tellement dynamiques qu’il est difficile de comprendre leur fonction avec les techniques utilisées pour l’étude d’autres protéines possédant une structure plus « ordonnée ». Les détails moléculaires qui sous-tendent la fonction des protéines d'échafaudage restent encore très difficiles à cerner.
Trouver le modus operandi des protéines désordonnées
L'équipe de Malene Jensen s’intéresse à une voie de signalisation en particulier, celle des JNKs, et aux protéines d’échafaudage qui la composent. Cette voie de signalisation intervient en situation de stress dans la cellule, comme lors de l’exposition aux UVs ou pendant l’inflammation, et organise en conséquence des réponses comme la prolifération ou la mort de la cellule. L'ambition du projet soutenu par Impulscience® est d'obtenir une description complète de la fonction de deux protéines d'échafaudage dans la voie de signalisation JNK : POSH et JIP1. La spectroscopie par résonance magnétique nucléaire (RMN) est au cœur de ce projet : c’est la seule technique qui peut fournir un aperçu à résolution atomique des détails structurels, dynamiques et fonctionnels de ce type de protéines. Cette technique permettra d’étudier la structure de POSH et JIP1, la façon dont elles interagissent avec d’autres protéines de la voie de signalisation JNK, et la façon dont elles s’associent entre elles pour former un complexe de super-échafaudage. Cette étude pourrait ainsi redéfinir entièrement la vision actuelle de la fonction des protéines d'échafaudage. L’étude des mécanismes qui sous-tendent la spécificité de la signalisation cellulaire est particulièrement pertinente, car la dérégulation de nombreuses voies de signalisation est associée à des maladies telles que le cancer et les troubles métaboliques.
Malene Jensen en quelques mots
Malene Jensen est chimiste et a obtenu son doctorat à l’Université de Copenhague (Danemark) en 2006. Elle possède une grande expérience dans l'étude de la structure et de la dynamique des protéines par résonance magnétique nucléaire, en particulier sur les protéines avec des domaines désordonnés (désordre intrinsèque). Ses travaux ont ainsi contribué à l'étude du rôle du désordre intrinsèque dans différents systèmes biologiques, tel que le virus de la rougeole, et dans certaines protéines associées aux maladies neurodégénératives. Elle a rejoint le CNRS en 2010, et avec son équipe à Grenoble elle contribue fortement à la compréhension du rôle de la dynamique conformationnelle de protéines impliquées dans les cycles de vie des bactériophages tempérés. Elle applique également des techniques de résonance magnétique nucléaire innovantes et de cristallographie aux rayons X pour cartographier la dynamique des protéines désordonnées en complexe avec leurs partenaires, illustrée par les protéines de la voie de signalisation JNK. Son parcours et contributions à son domaine de recherche ont été récompensés par la médaille de bronze du CNRS en 2015.

Programme Impulscience
Impulscience attribue chaque année 7 nouveaux soutiens à des chercheuses et chercheurs en sciences de la vie. Concentré sur le milieu de carrière, ce programme a pour objectif de soutenir cette étape cruciale pour le développement des projets de recherche.
Tous les lauréats du prix